Джазовые переложения оркестра Сергея Жилина стали хитом вечера памяти Римского-Корсакова
09.02, 12:43
Джазовые переложения оркестра Сергея Жилина стали хитом вечера памяти Римского-Корсакова
09.02, 12:43
 Альтовая домра доказала статус яркого сольного инструмента
05.02, 20:57
Альтовая домра доказала статус яркого сольного инструмента
05.02, 20:57
 B2B-платформа Hainago получит 5 млрд рублей от китайского инвестора для развития в России
05.02, 19:04
B2B-платформа Hainago получит 5 млрд рублей от китайского инвестора для развития в России
05.02, 19:04
 На нижнекамском механическом заводе состоялся конкурс профессионального мастерства
31.01, 15:18
На нижнекамском механическом заводе состоялся конкурс профессионального мастерства
31.01, 15:18
 Алексей Галкин, генеральный директор ООО «БИТ» о роли СФО в структурировании активов и развитии финансового рынка
30.01, 20:59
Алексей Галкин, генеральный директор ООО «БИТ» о роли СФО в структурировании активов и развитии финансового рынка
30.01, 20:59
 Команда KAMA TYRES представила творческую программу на фестивале в Татарстане
28.01, 18:30
Команда KAMA TYRES представила творческую программу на фестивале в Татарстане
28.01, 18:30
Создан новый метод редактирования митохондриального генома
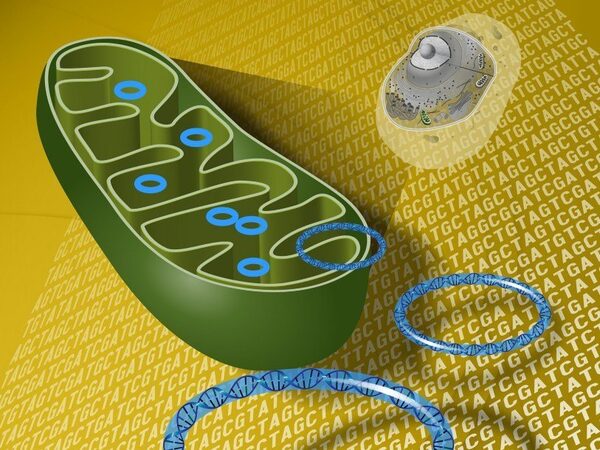
Корейские исследователи из Центра инженерии генома Института фундаментальных наук в городе Тэджон разработали новый метод редактирования генома, основанный на эффекторно-связанных деаминазах, подобных активатору транскрипции (transcription activator-like effector-linked deaminases, TALED). Он позволяет редактировать нуклеотидные основания в митохондриях, заменяя аденин на гуанин.
Митохондрии — самые «независимые» из клеточных органелл: у них есть собственный геном, кодирующий, правда, не все белки, нужные для работы митохондрий. Некоторые гены все-таки переехали из митохондрий в основной, ядерный геном клетки. В митохондриальном геноме человека осталось всего 37 генов. Существует ряд генетических заболеваний, которые вызваны мутациями в ДНК, содержащейся в митохондриях. Некоторые из этих болезней ведут к смерти ребенка или пожизненной инвалидности. Например, наследственная оптическая нейропатия Лебера (LHON), вызывающая внезапную слепоту на оба глаза, связана с точечной мутацией в митохондриальной ДНК. Другое заболевание — митохондриальная энцефаломиопатия с лактоацидозом и инсультоподобными эпизодами — медленно разрушает мозг. Известно 90 точечных мутаций митохондриальной ДНК, вызывающих болезни, которые в общей сложности затрагивают не менее 1 человека из 5000. В последние годы в связи с этими болезнями всё активнее предлагается метод митохондриального донорства.
Что же касается возможностей редактирования генома, то до последнего времени все впечатляющие успехи были связаны с изменением генома в клеточном ядре, а не в митохондриях. Многие существующие инструменты редактирования генома нельзя использовать из-за ограничений методов доставки в митохондрии. Например, ставший знаменитым метод CRISPR-Cas неприменим для редактирования мутаций в митохондриях, поскольку направляющая молекула РНК не может проникнуть в митохондрию.
«Еще одна проблема заключается в нехватке животных моделей этих митохондриальных заболеваний. Это связано с тем, что в настоящее время невозможно сконструировать митохондриальные мутации, необходимые для создания таких животных моделей, — говорит директор Центра инженерии генома Ким Джин Су. — Отсутствие их очень затрудняет разработку и тестирование терапевтических средств для этих заболеваний».
В 2020 году исследователи под руководством Дэвида Лю из Института Броуда Массачусетского технологического института и Гарварда создали новый метод, названный редакторами оснований цитозина, производными от DddA (DddA-derived cytosine base editors, DdCBE), который может заменять в ДНК митохондрий цитозин на тимин. Однако эта техника имеет свои ограничения. Метод не только ограничен преобразованием C в T, но и работает лучше всего с последовательностью «тимин-цитозин», превращая ее в «тимин-тимин». Фактически этот метод может исправить только 9 из 90 подтвержденных патогенных митохондриальных точечных мутаций. Долгое время считалось, что преобразование другой пары нуклеотидных оснований — аденина в гуанин — в митохондриальной ДНК невозможно.
Преодолеть это ограничение смог метод TALED, предложенный авторами нынешнего исследования. Он позволяет заменять аденин на гуанин и исправлять еще 39 точечных мутаций митохондриальной ДНК, вызывающих заболевания. Исследователи создали TALED, объединив три разных компонента. Первый компонент представляет собой эффектор, подобный активатору транскрипции (TALE), который способен нацеливаться на последовательность ДНК. Вторым компонентом является TadA8e, адениндезаминаза для облегчения превращения аденина в гуанин. Третий компонент, DddAtox, представляет собой цитозиндезаминазу, которая делает ДНК более доступной для TadA8e.
Наиболее интересно, что фермент TadA8e работает с двухцепочечной ДНК митохондрий, хотя ранее считалось, что этот фермент специфичен только для одноцепочечной ДНК. Исследователи предположили, что DddAtox позволяет сделать двухцепочечную ДНК доступной за счет кратковременного раскручивания двойной цепи. Это мимолетное временное окно позволяет TadA8e, сверхбыстродействующему ферменту, быстро вносить необходимые изменения.
Метод был успешно испытан на клеточных культурах. Продолжая работать над развитием метода, его создатели также занимаются разработкой аналогичного способа редактирования генома хлоропластов в клетках растений.
Исследование опубликовано в журнале Cell.
По материалам: polit